Cellule staminali, in Italia 13 le cell factory riconosciute dall’Aifa
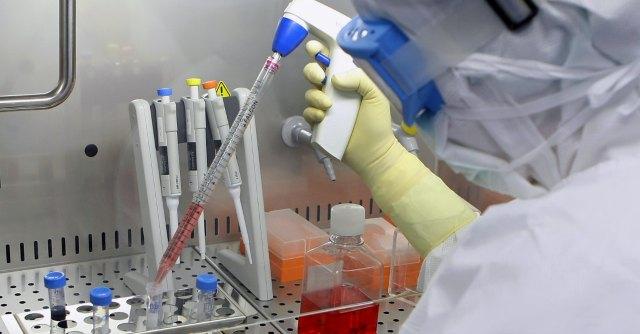
Nelle ultime settimane il termine cellule staminali in Italia è diventato sinonimo di controversia. Colpa delle polemiche suscitate dal contestato “metodo Stamina”, bocciato per mancanza di prove scientifiche dalla commissione di esperti del ministero della Salute, il cui decreto di nomina e, di conseguenza, parere contrario sono stati sospesi appena dal Tar del Lazio. Eppure il panorama della ricerca sulla cosiddetta medicina rigenerativa, di cui le cellule staminali, con la loro promessa di fornire pezzi di ricambio per l’organismo, sono la principale scommessa, è più variegato di Stamina.
Ma quanti sono nel nostro Paese i laboratori autorizzati ad approntare terapie avanzate a base di cellule staminali? Secondo l’Agenzia italiana del farmaco (Aifa), sono tredici le strutture di questo tipo, sia pubbliche, afferenti ad ospedali, che private. Battezzate Cell Factory, sono laboratori specializzati che producono terapie basate sull’uso di cellule, staminali ma non solo, come quelle dell’epidermide per i trapianti di pelle o del sistema immunitario nel trattamento di alcune leucemie.
A questo elenco si aggiungerà nelle prossime settimane, presso l’Università di Torino, un nuovo centro per l’impiego di staminali adulte nella cura dell’insufficienza renale ed epatica, per le quali oggi le uniche soluzioni sono rappresentate dal trapianto o dalla dialisi. Lo prevede un accordo firmato nei giorni scorsi tra l’Ateneo piemontese e il Fresenius Medical Care, gruppo mondiale specializzato nella dialisi. La sperimentazione inizierà a gennaio in alcuni neonati con disturbi renali e durerà almeno cinque anni.
“La caratteristica più importante di questa nuova realtà – spiega Giovanni Camussi, responsabile scientifico del Centro translazionale di medicina rigenerativa dell’Università di Torino – è che al suo interno si produrranno le cellule staminali epatiche identificate e caratterizzate nell’ambito del cosiddetto Torino Stem Cell Project. Queste cellule sono state brevettate e designate dalla European medicine agency (Ema), l’agenzia europea per i medicinali, come Orphan drug. Uno stato questo – chiarisce Camussi – assegnato a un farmaco per la cura di una malattia rara, con incidenza inferiore a 5 per 10 mila, al fine di incoraggiarne lo sviluppo da parte delle aziende farmaceutiche, attraverso una serie di agevolazioni fiscali e il regime di monopolio per sette anni dopo l’immissione in commercio”.
Le Cell Factory sono realtà relativamente giovani, nate negli ultimi quindici anni su impulso europeo per regolamentare le terapie avanzate a base di cellule, considerandole alla stessa stregua dei farmaci tradizionali. “Ritengo sia un’assurdità equiparare le cellule ai farmaci. Un farmaco, infatti, è un prodotto sempre uguale a se stesso, mentre le cellule, siano esse staminali, linfociti o cellule dell’epidermide, sono strutture più complesse, che mutano nel tempo anche se prelevate da uno stesso individuo – commenta Rita Maccario, responsabile della Cell Factory della Fondazione Irccs Policlinico San Matteo di Pavia -. Il regolamento europeo è stato concepito più per le aziende biotech, quindi con finalità commerciali. E ha cambiato tutto. Oggi qualsiasi terapia avanzata basata sulle cellule, per poter essere utilizzata come sperimentazione clinica, deve passare attraverso la creazione di una Cell Factory autorizzata dall’Aifa. Da qui è nata per gli ospedali la necessità di adeguarsi e mettersi in regola attraverso la creazione di queste strutture”. Ma come funziona una Cell Factory e quali sono i criteri di sicurezza cui devono sottostare questi centri? “La caratteristica fondamentale che differenzia una Cell Factory da un laboratorio tradizionale è il livello di pulizia. Il grado di contaminazione ambientale – sottolinea Giovanni Camussi – deve essere cento volte inferiore rispetto a quello di una sala operatoria. Ogni aspetto della realizzazione di una Cell Factory, dalle procedure di laboratorio alla tracciabilità dei prodotti utilizzati, dalla realizzazione della struttura alla formazione del personale specializzato, deve essere sottoposto a rigidi criteri di valutazione da parte dell’Aifa. Dal momento dell’invio della richiesta all’ispezione dell’Aifa passano circa sei mesi. Inoltre, dopo l’approvazione, le Cell Factory devono essere sottoposte a ispezioni regolari ogni due anni, sempre ad opera dell’Agenzia del farmaco”.
Proprio la scarsa trasparenza è uno dei punti che alimentano scetticismo intorno al cosiddetto metodo Stamina, con il rischio di creare confusione sulle terapie a base di staminali. Una realtà, quest’ultima, in continua evoluzione e con grandi potenzialità di crescita, al netto delle polemiche di questi mesi. “La ricerca sulle staminali – precisa Camussi – ha creato grandi aspettative. È tuttavia indispensabile che venga sviluppata in un rigoroso contesto scientifico per evitare strumentalizzazioni e facili illusioni. Il processo per arrivare a un’applicazione clinica è ancora lungo, irto di ostacoli e richiede importanti investimenti. In particolar modo, che la ricerca sia riproducibile e verificabile in ambito scientifico e condotta secondo linee guida approvate dalla comunità scientifica e dalle autorità regolatorie”.

