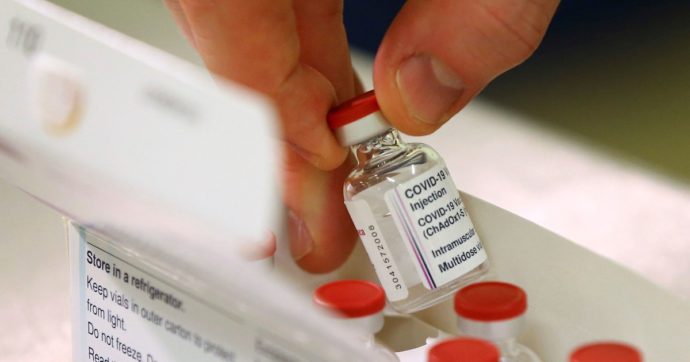
Dopo il via libera delle autorità europee, anche l’Agenzia italiana del farmaco (Aifa) ha dato l’ok per la somministrazione nel nostro Paese del vaccino anti-Covid prodotto da Astrazeneca, università di Oxford e Irbm di Pomezia. Il farmaco non prevede limiti di età per i maggiorenni, ma l’indicazione degli esperti è di utilizzarlo “in via preferenziale” per chi ha “dai 18 ai 55 anni“. Una scelta ancora più decisa rispetto a quella dell’Ema: l’Agenzia europea, infatti, non ha suggerito un’età “consigliata” di somministrazione, ma ha comunque palesato i suoi dubbi sulla reale efficacia del vaccino sui più anziani. La maggior parte dei partecipanti ai test condotti dall’azienda, infatti, “aveva un’età compresa tra i 18 ei 55 anni. Non ci sono ancora abbastanza risultati nei partecipanti più anziani (oltre i 55 anni) per fornire una cifra su quanto bene funzionerà il vaccino in questo gruppo”.
La decisione dell’Aifa è stata accolta positivamente da Silvio Garattini, presidente dell’Istituto di ricerche farmacologiche Mario Negri: “È una giusta scelta perché i dati disponibili riguardano l’efficacia in questa fascia d’età. Non ci sono dati che permettono di stabilire che gli anziani, che magari hanno importanti fattori di rischio, abbiano beneficio da questo vaccino”. Le cose, però, presto potrebbero cambiare: “È una situazione dinamica, speriamo che ci siano nuove ricerche che permettano di utilizzare questo vaccino anche nelle fasce d’età ora escluse“. Soddisfatto anche il dg dell’Aifa, Nicola Magrini: “L’arrivo di un terzo vaccino rappresenta un importante contributo alla campagna vaccinale in corso. L’agenzia ha fornito indicazioni per ottimizzare l’utilizzo dei vaccini esistenti sfruttandone al meglio le diverse caratteristiche”.
La Commissione tecnico-scientifica (CTS) dell’Aifa, riunitasi il 30 gennaio 2021, ha confermato la valutazione dell’Ema sull’efficacia (59,5% nella riduzione delle infezioni sintomatiche da COVID-19) e sul rapporto beneficio/rischio favorevole del vaccino. “Abbiamo quindi una valida opzione aggiuntiva nel contrasto della pandemia, anche in considerazione della maggiore maneggevolezza d’uso di questo vaccino”. Rispetto al farmaco prodotto da Pfizer, infatti, che deve essere conservato a -70 gradi, per quello di Astrazeneca sono sufficienti le normali temperature di frigorifero. “Seppure i dati a disposizione indichino una efficacia inferiore a quella degli altri due vaccini disponibili, la comparazione tra i tre vaccini è difficile, tenuto conto delle diversità delle popolazioni studiate e della necessità di completare gli studi“, si legge nel comunicato rilasciato dall’Aifa. “In particolare, i dati degli studi registrativi del vaccino AstraZeneca mostrano un livello di incertezza nella stima di efficacia nei soggetti sopra i 55 anni, in quanto tale popolazione (nella quale tuttavia si è osservata una buona risposta anticorpale) era scarsamente rappresentata“.
Per questo, la Commissione ha suggerito che i vaccini a Rna messaggero (Pfizer e Moderna) siano destinati ai “soggetti più anziani e/o più fragili. Per la definizione di specifiche categorie di rischio si rimanda a quanto previsto dal piano strategico per la vaccinazione anti SARS-CoV2/Covid-19 del Ministero della Salute”. Quello di Astrazeneca, invece, è rivolto a chi ha tra 18 e 55 anni “in attesa di acquisire ulteriori dati“. La Commissione si è riservata infine di “fornire indicazioni puntuali su aspetti più specifici, quali l’intervallo tra la somministrazione delle due dosi, a seguito di ulteriori approfondimenti”. Soddisfatto anche il presidente dell’Agenzia Giorgio Palù: “Abbiamo una ulteriore arma contro la pandemia. Altre presto se ne aggiungeranno. È auspicabile un approccio integrato tra vaccini e terapie anti Covid-19 attualmente in uso e in sperimentazione”.
Articolo Precedente
Monoclonali, virologo Guido Silvestri incalza: “Il prossimo ministro autorizzi rapidamente. Ma si faccia anche luce sulle cause del ritardo”

Articolo Successivo
Coronavirus, i dati – 12.715 nuovi casi con 298mila test: tasso di positività in calo. Altri 421 morti. Giù i ricoveri e le terapie intensive