Alzheimer, sperimentato un farmaco in grado di rallentare il declino cognitivo. Passi avanti anche sulla diagnosi precoce
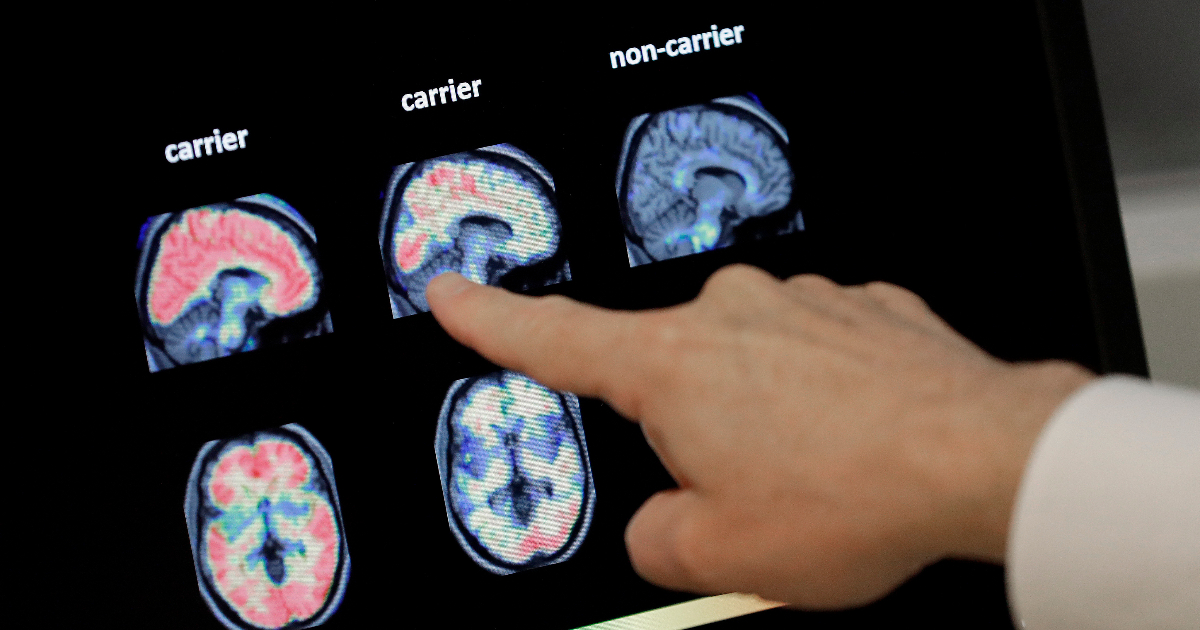
Una ricerca dell'Università di Yale sul lecanemab ha evidenziato una riduzione del declino cognitivo del 27% in 18 mesi. Molti, tuttavia, gli effetti collaterali riscontrati. Altri due studi mettono invece a fuoco i meccanismi fisiologici alla base dell'insorgenza della malattia e la possibilità di riconoscere precocemente i sintomi attraverso degli specifici marcatori
Si tratta senza dubbio di una delle malattie che maggiormente colpiscono la dignità delle persone, minandone l’identità e la storia oltre che le capacità di relazione. Ma oggi dal fronte della ricerca scientifica arrivano diverse notizie che donano speranze concrete a tutti i malati di Alzheimer e ai loro parenti. Iniziamo dai risultati di uno studio condotto su di un farmaco che sembra offrire un nuovo strumento di lotta per combattere il morbo e i suoi effetti: il lecanemab. I dati dello studio in questione, pubblicato sul New England Journal of Medicine hanno confermato che il lecanemab, somministrato per via endovenosa ogni due settimane, ha rallentato il declino della memoria del 27% in 18 mesi. A commento dello studio Alfredo Berardelli, professore di neurologia, Sapienza Università di Roma e presidente della Società Italiana di Neurologia, ha dichiarato: “Riuscire a dimostrare che con una terapia si può contrastare l’accumulo di sostanze proteiche è in teoria un risultato molto importante. I precedenti studi avevano solo fatto vedere che con anticorpi monoclonali si rallentava la formazione di placche, questo studio dimostra che con un trattamento di 18 mesi i pazienti avevano un miglioramento lieve delle funzioni cognitive”. Berardelli ha però anche aggiunto: “E’ necessario, comunque analizzare con maggiore attenzione i risultati dello studio per formulare un parere maggiormente fondato e probabilmente saranno necessari anche altri studi con un periodo di trattamento più lungo dei 18 mesi del presente studio”.
La ricerca è stata condotta su 1.795 pazienti di età compresa tra 50 e 90 anni a cui era stato diagnosticato un Alzheimer precoce. Alla metà è stato somministrato il lecanemab e all’altra metà un placebo. La gravità della loro demenza è stata valutata utilizzando una scala clinica che ha tenuto conto di diversi sintomi tra cui dimenticanze, difficoltà relazionali, capacità di risoluzione dei problemi e di vivere in modo indipendente. La malattia è progredita in entrambi i gruppi durante il periodo di studio di 18 mesi, ma è peggiorata molto meno rapidamente in quelli che assumevano il lecanemab. Lo studio peer-reviewed, condotto dal professor Christopher van Dyck, direttore dell’Unità di ricerca sul morbo di Alzheimer dell’Università di Yale, USA, ha scoperto anche che il lecanemab è associato a diversi effetti collaterali tra cui mal di testa e microsanguinamenti nel cervello. Circa il 6,9% dei partecipanti allo studio nel gruppo lecanemab ha interrotto lo studio a causa di eventi avversi, rispetto al 2,9% di quelli nel gruppo placebo. Complessivamente, si sono verificati eventi avversi gravi nel 14% del gruppo lecanemab e nell’11,3% del gruppo placebo. Gli eventi avversi più comuni nel gruppo dei farmaci sono stati le reazioni alle infusioni endovenose e le anomalie nelle loro risonanze magnetiche, come gonfiore cerebrale ed emorragia cerebrale chiamate anomalie di imaging correlate all’amiloide o ARIA. L’emorragia cerebrale ARIA è stata osservata nel 17,3% di coloro che hanno ricevuto lecanemab e nel 9% di quelli nel gruppo placebo. Il gonfiore cerebrale ARIA è stato documentato nel 12,6% con lecanemab e nell’1,7% con placebo, secondo i dati dello studio.
I ricercatori hanno anche scritto che circa lo 0,7% dei partecipanti al gruppo lecanemab e lo 0,8% di quelli del gruppo placebo sono morti, corrispondenti a sei decessi documentati nel gruppo lecanemab e sette nel gruppo placebo. “Nessun decesso è stato considerato dagli studiosi correlato al lecanemab o verificatosi con ARIA”, hanno scritto. Ad ogni modo, al di là delle controindicazioni riscontrate, i ricercatori sono fiduciosi che questo possa essere un primo passo verso la sconfitta della malattia. Una sconfitta che passa anche attraverso l’individuazione delle cause dell’Alzheimer e attraverso una diagnosi che sia la più pronta possibile. Quanto al primo lato della faccenda, sempre ricercatori di Yale hanno scoperto che il gonfiore causato da un sottoprodotto delle placche amiloidi nel cervello, un segno distintivo dell’Alzheimer, potrebbe essere la vera causa dei sintomi debilitanti della malattia. E hanno identificato un biomarcatore che potrebbe aiutare i medici a diagnosticare meglio l’Alzheimer e fornire un bersaglio per terapie future. La notizia è stata riportata sulla rivista Nature. Secondo i loro risultati, ogni formazione di placca può causare un accumulo di rigonfiamenti a forma di sferoide lungo centinaia di assoni – i sottili fili cellulari che collegano i neuroni del cervello – vicino ai depositi di placca amiloide. I rigonfiamenti sono causati dal graduale accumulo di organelli all’interno delle cellule note come lisosomi, che sono noti per digerire i rifiuti cellulari. Man mano che i rigonfiamenti si ingrandiscono – dicono i ricercatori – possono attenuare la trasmissione dei normali segnali elettrici da una regione del cervello a un’altra. Questo accumulo di sferoidi provoca gonfiore lungo gli assoni, che a sua volta innesca gli effetti devastanti della demenza.
I ricercatori hanno scoperto che una proteina nei lisosomi chiamata PLD3 ha causato la crescita e l’aggregazione di questi organelli lungo gli assoni, portando infine al rigonfiamento degli assoni e alla rottura della conduzione elettrica. Quando hanno usato la terapia genica per rimuovere il PLD3 dai neuroni nei topi con una condizione simile al morbo di Alzheimer hanno scoperto che ciò ha portato a una drastica riduzione del gonfiore assonale. Questo, a sua volta, ha normalizzato la conduzione elettrica degli assoni e migliorato la funzione dei neuroni nelle regioni cerebrali collegate da questi assoni. I ricercatori affermano che il PLD3 può essere utilizzato come marcatore nella diagnosi del rischio di malattia di Alzheimer. Un altro studio condotto alla NYU Grossman School of Medicine and Icahn School of Medicine al Mount Sinai, ha invece individuato un altro potenziale meccanismo di genesi della malattia: un cambiamento nel codice del DNA di un gene che svolge un ruolo chiave nelle difese immunitarie del cervello e che potrebbe dare corso alla malattia. I loro risultati sono stati pubblicati su Alzheimer’s and Dementia: The Journal of the Alzheimer’s Association.
Le nuove scoperte potrebbero offrire un potenziale bersaglio per le terapie in grado di influenzare direttamente le mutazioni genetiche, secondo gli autori dello studio. Il gene in questione, l’inositolo polifosfato-5-fosfatasi D (INPP5D), contiene istruzioni per la costruzione di enzimi che spingono le cellule immunitarie a fagocitare placche, pezzi danneggiati di cellule cerebrali, nonché batteri e virus. Nel caso di un suo malfunzionamento questo meccanismo di “pulizia” agirebbe con minor efficienza spianando la strada al morbo. Sul fronte invece dell’individuazione delle prime fasi della malattia, un potente – e agevole alleato – potrebbe venirci dalle nostre urine. Un nuovo studio pubblicato in Frontiers in Aging Neuroscience suggerisce che l’acido formico urinario sia un marcatore assai sensibile del declino cognitivo soggettivo che può indicare le primissime fasi della malattia di Alzheimer. I ricercatori alla base di questo nuovo studio hanno precedentemente studiato un composto organico chiamato formaldeide come biomarcatore urinario per l’Alzheimer. Tuttavia, c’era spazio per miglioramenti nel rilevare la malattia in fase iniziale. In questo ultimo studio si sono concentrati principalmente sull’acido formico, un prodotto metabolico della formaldeide, per vedere se funzionava meglio come biomarcatore. Un totale di 574 persone hanno partecipato allo studio – volontari sani o con diversi gradi di progressione della malattia. I ricercatori hanno analizzato i campioni di urina e sangue dei partecipanti e hanno eseguito valutazioni psicologiche. Lo studio ha scoperto che i livelli di acido formico urinario erano significativamente aumentati in tutti i gruppi di partecipanti con l’Alzheimer rispetto ai sani, incluso il gruppo con declino cognitivo soggettivo in fase iniziale. Ciò suggerisce che l’acido formico potrebbe fungere da biomarcatore per la malattia anche in fase iniziale. Insomma non siamo probabilmente ancora in grado di debellare una volta e per tutte la malattia. Ma ancora una volta la ricerca e il metodo scientifico ci hanno portato qualche passo in avanti, permettendo di fondare le nostre speranze sulla solidità dei dati sperimentali.
di Gianmarco Pondrano Altavilla